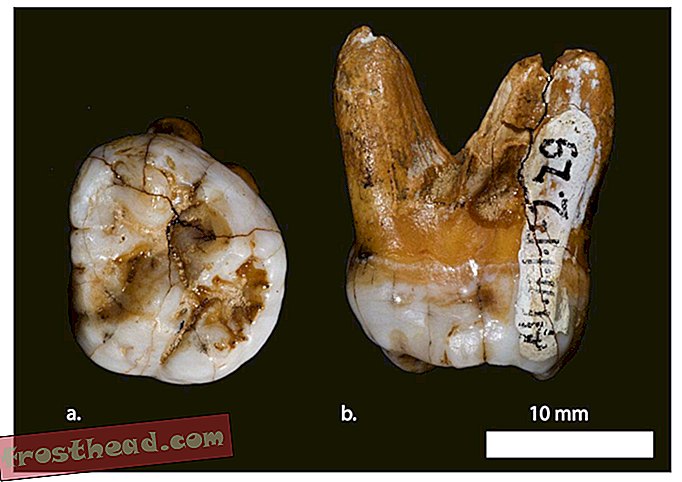
Stellen Sie sich den Nervenkitzel der Entdeckung vor, wenn mehr als 10 Jahre Forschung über die Ursache einer häufigen genetisch bedingten Krankheit, der Mukoviszidose (Mukoviszidose, CF), dazu führen, dass sie auf eine Gruppe unterschiedlicher, aber mysteriöser Europäer zurückgeführt wird, die vor etwa 5.000 Jahren lebten.
Mukoviszidose ist die häufigste potenziell tödliche Erbkrankheit bei Kaukasiern - etwa jeder 40. trägt die sogenannte F508del-Mutation. Typischerweise breiten sich nur vorteilhafte Mutationen in einer Population aus, die einen Überlebensvorteil bieten.
Mukoviszidose hemmt die Freisetzung von Verdauungsenzymen aus der Bauchspeicheldrüse, die eine Mangelernährung auslösen, Lungenerkrankungen verursachen, die letztendlich tödlich verlaufen und im Schweiß einen hohen Salzgehalt erzeugen, der lebensbedrohlich sein kann.
In den letzten Jahren haben Wissenschaftler viele Aspekte dieser tödlichen Lungenerkrankung aufgedeckt, die zu einer routinemäßigen Früherkennung bei gescreenten Babys, besseren Behandlungen und längeren Lebensdauern geführt haben. Andererseits konnte die wissenschaftliche Gemeinschaft nicht herausfinden, wann, wo und warum die Mutation so häufig wurde. Durch die Zusammenarbeit mit einem außergewöhnlichen Team europäischer Wissenschaftler wie David Barton in Irland und Milan Macek in der Tschechischen Republik, insbesondere einer Gruppe brillanter Genetiker in Brest, Frankreich, unter der Leitung von Emmanuelle Génin und Claude Férec, glauben wir, dass wir jetzt wissen, wo und wann Die ursprüngliche Mutation entstand und in welchem uralten Volksstamm.
Wir teilen diese Erkenntnisse in einem Artikel im European Journal of Human Genetics, der den Höhepunkt einer 20-jährigen Arbeit darstellt, an der neun Länder beteiligt sind.
Was ist Mukoviszidose?
Meine Suche nach der Entstehung und Ursache von CF begann kurz nach der Entdeckung des CFTR-Gens, das die Krankheit 1989 verursachte. Die häufigste Mutation dieses Gens, das die Krankheit verursacht, hieß F508del. Zwei Kopien der Mutation - eine von der Mutter und die andere vom Vater - verursachten die tödliche Krankheit. Das Erben nur einer einzigen Kopie verursachte jedoch keine Symptome und machte die Person zu einem „Träger“.
Ich war seit 1977 als Arzt und Wissenschaftler an der Universität von Wisconsin beschäftigt und beschäftigte mich mit der Früherkennung von Mukoviszidose durch Neugeborenen-Screening. Vor der Entdeckung von Genen identifizierten wir Babys mit hohem Risiko für CF mithilfe eines Bluttests, bei dem der Proteingehalt gemessen wurde, der als immunreaktives Trypsinogen (IRT) bezeichnet wird. Hohe IRT-Werte deuten darauf hin, dass das Baby an CF erkrankt war. Als ich von der Entdeckung von Genen erfuhr, war ich überzeugt, dass sie sowohl für die Entwicklung von Screeningtests als auch für die epidemiologische Forschung von grundlegender Bedeutung sein würde.
Das liegt daran, dass wir Eltern mit dem Gen einen aussagekräftigeren Test anbieten können. Wir konnten ihnen nicht nur sagen, ob ihr Kind Mukoviszidose hatte, sondern auch, ob sie zwei Kopien einer CFTR-Mutation trugen, die eine Krankheit verursachte, oder nur eine Kopie, die sie zu einem Träger machte.
Man könnte sich fragen, was der Zusammenhang zwischen dem Studium des CF-Neugeborenen-Screenings und dem Erlernen der Krankheitsursache ist. Die Antwort liegt darin, wie unser Forschungsteam in Wisconsin einen biochemischen Screening-Test unter Verwendung des IRT-Markers auf eine zweistufige Methode namens IRT / DNA umgestellt hat.
Da etwa 90 Prozent der CF-Patienten in den USA und in Europa mindestens eine F508del-Mutation aufweisen, haben wir begonnen, neugeborenes Blut immer dann auf Vorhandensein zu untersuchen, wenn der IRT-Spiegel hoch war. Wenn dieses zweistufige IRT / DNA-Screening durchgeführt wird, werden nicht nur Patienten mit der Krankheit diagnostiziert, sondern auch zehnmal mehr Säuglinge, die genetische Überträger der Krankheit sind, identifiziert.
Da sich in den letzten zwei Jahrzehnten das prä-, pränatale und neonatale Screening auf Mukoviszidose vermehrt hat, stellten die vielen Tausend Personen, die herausfanden, dass sie F508del-Träger waren, und ihre betroffenen Eltern häufig die Frage nach dem Ursprung und der Bedeutung dieser Mutation selbst oder in ihren Augen Kinder. Würden sie mit einer Kopie leiden? Gab es einen gesundheitlichen Nutzen? Es war frustrierend für einen auf CF spezialisierten Kinderarzt, keine Antwort auf diese Fragen zu haben.
Die Herausforderung, den Ursprung der CF-Mutation zu finden
Ich wollte herausfinden, wann diese genetische Mutation zum ersten Mal auftaucht. Wenn wir diesen Zeitraum genau bestimmen, können wir nachvollziehen, wie sich dieser hätte entwickeln können, um denjenigen in Europa, die ihn hatten, zumindest anfangs einen Nutzen zu verschaffen. Um meine Forschung zu erweitern, entschied ich mich für ein Sabbatical und eine Ausbildung in Epidemiologie, während ich 1993 Kurse an der London School of Hygiene and Tropical Medicine belegte.
Das Timing war perfekt, denn das Feld der alten DNA-Forschung begann zu blühen. Neue bahnbrechende Techniken wie die Polymerase-Kettenreaktion ermöglichten die Untersuchung der DNA von Mumien und anderen menschlichen archäologischen Proben aus prähistorischen Bestattungen. Beispielsweise wurden frühe Studien an der DNA des 5.000 Jahre alten Tiroler Eismanns durchgeführt, der später unter dem Namen Ötzi bekannt wurde.
Ich entschied, dass wir in der Lage sein könnten, den Ursprung von Mukoviszidose zu entdecken, indem wir die DNA in den Zähnen von Menschen aus der Eisenzeit analysieren, die zwischen 700 und 100 v. Chr. Auf europäischen Friedhöfen beerdigt wurden.
Mit dieser Strategie habe ich mich mit Archäologen und Anthropologen wie Maria Teschler-Nicola am Naturhistorischen Museum in Wien zusammengetan, die Zugang zu 32 um 350 v. Chr. Bei Wien begrabenen Skeletten verschafften. Genetiker in Frankreich sammelten DNA von den alten Backenzähnen und analysierten die DNA. Zu unserer Überraschung entdeckten wir das Vorhandensein der F508del-Mutation in der DNA von drei von 32 Skeletten.
Diese Entdeckung von F508del in Bestattungen aus der mitteleuropäischen Eisenzeit mit einem Radiokohlenstoffgehalt von 350 v. Chr. Ließ vermuten, dass die ursprüngliche CF-Mutation früher aufgetreten sein könnte. Die Beschaffung von Exemplaren aus der Bronzezeit und der Jungsteinzeit für solche direkten Studien erwies sich jedoch als schwierig, da weniger Bestattungen zur Verfügung stehen, die Skelette nicht so gut erhalten sind und jeder Friedhof lediglich einen Stamm oder ein Dorf darstellt. Anstatt von der alten DNA abhängig zu sein, haben wir unsere Strategie dahingehend geändert, die Gene des modernen Menschen zu untersuchen, um herauszufinden, wann diese Mutation zum ersten Mal auftrat.
Warum würde sich eine schädliche Mutation ausbreiten?
Wir wussten, dass wir mehr über die Signaturmutation - F508del - bei Menschen, die Träger der Krankheit sind oder an der Krankheit leiden, erfahren müssen, um den Ursprung der CF bei modernen Patienten zu finden.
Diese winzige Mutation verursacht den Verlust einer Aminosäure aus der Kette von 1.480 Aminosäuren und verändert die Form eines Proteins auf der Oberfläche der Zelle, das Chlorid in die Zelle hinein und aus der Zelle heraus befördert. Wenn dieses Protein mutiert ist, sind Menschen, die zwei Kopien davon tragen - eine von der Mutter und eine vom Vater - mit dickem klebrigem Schleim in Lunge, Bauchspeicheldrüse und anderen Organen geplagt. Der Schleim in der Lunge lässt Bakterien gedeihen, zerstört das Gewebe und führt schließlich zum Versagen der Lunge. In der Bauchspeicheldrüse verhindern die dicken Sekrete, dass die Drüse die Enzyme abgibt, die der Körper benötigt, um Nahrung zu verdauen.
Warum also sollte eine solch schädliche Mutation weiterhin von Generation zu Generation übertragen werden?
Eine so schädliche Mutation wie F508del hätte bei Menschen mit zwei Kopien des mutierten CFTR-Gens niemals überlebt, da sie wahrscheinlich bald nach der Geburt gestorben wären. Andererseits können diejenigen mit einer Mutation einen Überlebensvorteil haben, wie in Darwins Theorie „Überleben der Stärksten“ vorhergesagt.
Das vielleicht beste Beispiel für eine Mutation, die das Überleben unter stressigen Umweltbedingungen begünstigt, ist Afrika, wo die tödliche Malaria seit Jahrhunderten endemisch ist. Der Parasit, der Malaria verursacht, infiziert die roten Blutkörperchen, deren Hauptbestandteil das sauerstofftragende Protein Hämoglobin ist. Personen, die das normale Hämoglobin-Gen tragen, sind anfällig für diese von Mücken übertragene Krankheit. Aber diejenigen, die Träger des mutierten „Hämoglobin S“ -Gens sind und nur eine Kopie besitzen, sind vor schwerer Malaria geschützt. Zwei Kopien des Hämoglobin-S-Gens verursachen jedoch Sichelzellenerkrankungen, die tödlich sein können.
Hier liegt ein klarer Vorteil darin, ein mutiertes Gen zu tragen - tatsächlich trägt etwa jeder zehnte Afrikaner eine einzige Kopie. Daher begünstigt seit vielen Jahrhunderten ein Umweltfaktor das Überleben von Personen, die eine einzige Kopie der Sichel-Hämoglobin-Mutation tragen.
In ähnlicher Weise haben wir uns gefragt, ob es gesundheitlich von Vorteil ist, eine einzige Kopie dieser spezifischen CF-Mutation bei Exposition gegenüber umweltbelastenden Bedingungen zu tragen. Vielleicht war die Mutation F508del deshalb bei Europäern mit kaukasischen Wurzeln und in Europa lebenden Bevölkerungsgruppen häufig.
Hinweise aus der modernen DNA
Um den Vorteil der Übertragung eines einzelnen mutierten F508del-Gens von Generation zu Generation herauszufinden, mussten wir zunächst bestimmen, wann und wo die Mutation auftrat, damit wir den Nutzen dieser Mutation ermitteln konnten.
Wir erhielten DNA-Proben von 190 CF-Patienten mit F508del und ihren Eltern, die in geografisch unterschiedlichen europäischen Populationen von Irland bis Griechenland sowie einer von Deutschland stammenden Bevölkerung in den USA lebten. Anschließend identifizierten wir eine Sammlung genetischer Marker - im Wesentlichen DNA-Sequenzen - innerhalb des CF-Gens und flankierende Stellen auf dem Chromosom. Indem wir herausfanden, wann diese Mutationen in den untersuchten Populationen auftraten, konnten wir das Alter des letzten gemeinsamen Vorfahren abschätzen.
Anschließend haben wir durch strenge Computeranalysen das Alter der CF-Mutation in jeder in den verschiedenen Ländern lebenden Bevölkerung geschätzt.
Wir haben dann festgestellt, dass das Alter des ältesten gemeinsamen Vorfahren zwischen 4.600 und 4.725 Jahren liegt und in Südwesteuropa entstanden ist, wahrscheinlich in Siedlungen entlang des Atlantiks und vielleicht in der Region Frankreichs oder Portugals. Wir glauben, dass sich die Mutation von dort schnell nach Großbritannien und Irland und später nach Mittel- und Südosteuropa ausbreitete, beispielsweise nach Griechenland, wo F508del erst vor etwa 1.000 Jahren eingeführt wurde.
Wer hat die CF-Mutation in ganz Europa verbreitet?
So legen unsere neu veröffentlichten Daten nahe, dass die F508del-Mutation in der frühen Bronzezeit aufgetreten ist und sich während alter Wanderungen von West- nach Südosteuropa ausbreitet.
In Anbetracht der archäologischen Aufzeichnungen ermöglichen unsere Ergebnisse die Einführung eines neuen Konzepts, das darauf hindeutet, dass eine Bevölkerung, die als Bell-Beaker-Volk bekannt ist, wahrscheinlich migriert und für die frühe Verbreitung von F508del im prähistorischen Europa verantwortlich ist. Sie erschienen am Übergang von der spätneolithischen Periode um 4000 v. Chr. Zur frühen Bronzezeit im dritten Jahrtausend v. Chr. Irgendwo in Westeuropa. Sie zeichneten sich durch Keramikbecher, wegweisende Kupfer- und Bronzemetallurgie nördlich der Alpen und große Mobilität aus. Tatsächlich zeigen alle Studien, dass sie stark migrierten und durch ganz Westeuropa reisten.
In rund 1.000 Jahren verbreitete ein Netzwerk kleiner Familien und / oder Elite-Stämme ihre Kultur von West nach Ost in Regionen, die eng mit der heutigen Europäischen Union korrespondieren, in der die höchste Inzidenz von Mukoviszidose zu verzeichnen ist. Ihre Wanderungen sind mit dem Aufkommen der westeuropäischen und mitteleuropäischen Metallurgie verbunden, da sie auf langen Strecken Metallwaren, insbesondere Waffen, herstellten und handelten. Es wird auch spekuliert, dass ihre Reisen durch den Aufbau von Ehe-Netzwerken motiviert wurden. Am relevantesten für unsere Studie ist der Nachweis, dass sie in eine Richtung und über einen Zeitraum hinweg gewandert sind, die gut zu unseren Ergebnissen passen. Jüngste genomische Daten legen nahe, dass sowohl Migration als auch kulturelle Übertragung eine wichtige Rolle bei der Verbreitung des „Beaker Complex“ spielten und nach 2400 v. Chr. Zu einem „tiefgreifenden demografischen Wandel“ in Großbritannien und anderswo führten
Die Feststellung, wann F508del zum ersten Mal in Europa eingeführt wurde, und seine Entstehungsorte sollten neue Erkenntnisse über die hohe Verbreitung von Trägern liefern - und darüber, ob die Mutation einen evolutionären Vorteil bringt. So blieben Europäer aus der Bronzezeit offenbar von der Exposition gegenüber endemischen Infektionskrankheiten oder Epidemien verschont, obwohl sie stark migrierten. Ein Schutz vor einer Infektionskrankheit wie bei der Sichelzellenmutation durch diese genetische Mutation erscheint daher unwahrscheinlich.
Je mehr Informationen über Menschen aus der Bronzezeit und ihre Praktiken während der Migration durch archäologische und genomische Untersuchungen verfügbar werden, desto mehr Hinweise auf Umweltfaktoren, die Menschen mit dieser Genvariante begünstigten, sollten auftauchen. Dann können wir möglicherweise Fragen von Patienten und Eltern beantworten, warum sie eine CFTR-Mutation in ihrer Familie haben und welchen Vorteil dies bringt.
Dieser Artikel wurde ursprünglich auf The Conversation veröffentlicht.
Philip Farrell, Professor für Pädiatrie und Bevölkerungsgesundheit an der University of Wisconsin-Madison