Es gibt ein Foto von LaDonna Lopossa, das die Geschichte erzählt. Sie lächelt und liegt auf ihrem eigenen Friedhofsgrundstück auf dem Rasen. Das Porträt war die Idee ihres Mannes - in ihren Jahrzehnten schien George, auch bekannt als Mr. No Serious, nie einen Knebel gesehen zu haben, den er nicht mochte -, aber es war LaDonna, die die Käsekuchen-Pose erfand.
Verwandte Inhalte
- Große Hoffnungen auf ein neues Gen.
- Die "geheimen Juden" von San Luis Valley
"Okay", hatte George gesagt, "jetzt zieh dein Hemd aus."
"George!"
Klicken.
Einerseits ist es eine alberne Momentaufnahme einer 60-jährigen Frau in einer Strickjacke und vernünftigen Sandalen in Winlock, Washington, an einem sonnigen Tag im Mai 2000. Andererseits ist es ein Blick auf eine mögliche Zukunft, in der sich die Wissenschaft gelöst hat ein furchterregendes Problem. Auf diese Weise sahen sich LaDonna und George ihrem tödlichen Krebs gegenüber und pfiffen nicht nur am Friedhof vorbei, sondern blödelten in der Mitte herum.
Drei Monate zuvor lag LaDonna in einem Krankenhausbett in Olympia und wollte gerade den Vorhang zuziehen. Es gab viel zu verlieren: vier erwachsene Kinder, mehrere Enkelkinder, Freunde in der Kirche, eine gute Ehe. (Egal, wie sie dort lag, George sagte den Krankenschwestern laut, dass er in die Bars gehen würde, um eine andere Frau zu finden, was sie als seine seltsame Anstrengung verstand, ihre Gedanken zu beruhigen.) Sie war bereit, alle und all diese Dinge zu verlassen und mehr wegen der Schmerzen.
Ihre Milz, die sich normalerweise unter der untersten linken Rippe befand und nicht größer als ein Pfirsich war, war so voller weißer Blutkörperchen, dass sie die Größe einer Kantalupe hatte. Sie konnte kaum laufen. Ihre Haut war gespenstisch, ihr Blut hatte gefährlich wenig rote Blutkörperchen. Atmen war mühsam. Regelmäßiges Erbrechen. Stechende Schmerzen tief in ihren Knochen, wo das Mark wild weiße Blutkörperchen oder Leukozyten ausstieß. Wiederkehrendes Fieber. Und kalt, seltsam, unangenehm kalt : Sie fror unter den Decken des Krankenhauses.
Sie war zu alt und zu krank, um sich einer Knochenmarktransplantation zu unterziehen, einer anstrengenden, sehr riskanten Behandlung für ihren Blutkrebs, die chronische myeloische Leukämie (CML). Sie hatte bereits die andere Standard-CML-Behandlung ausprobiert, regelmäßige Dosen des starken Wirkstoffs Interferon. Aber es verstärkte ihre Übelkeit, Fieber und Knochenschmerzen so sehr, dass sie das Medikament absetzte, wie auch immer. Die Ärzte hatten nichts mehr in ihrem Arsenal zur Bekämpfung von Leukämie übrig und waren auf Dilaudid, ein Derivat von Morphin, dem narkotischen Schmerzmittel, zurückzuführen. Es war beruhigend, es war beruhigend und für eine Patientin in ihrem Zustand war es natürlich das Ende.
George hatte die meisten ihrer Habseligkeiten verschenkt und einen U-Haul-Truck reserviert, um seine Sachen nach Südkalifornien zu transportieren, wo er bei einem ihrer Söhne einziehen würde. Die Musik für ihre Beerdigung wurde ausgewählt, einschließlich "Weil mir viel gegeben wurde", um von den Enkelkindern gesungen zu werden. Als das Krankenhaus vorschlug, LaDonna in ein Hospiz zu verlegen, nahm George sie stattdessen mit nach Hause und befolgte den Rat ihres Arztes, um die Kinder zu rufen. Terry, Darren und Stephen sind aus der Gegend von Los Angeles geflogen, und Kelly ist von ihrem Platz in Winlock herübergefahren. Einer nach dem anderen gingen sie ins Schlafzimmer, setzten sich an LaDonnas Bett und verabschiedeten sich.
CML ist eine der vier Hauptarten der Leukämie bei Erwachsenen, aber es ist nicht üblich, dass jedes Jahr 5.000 Menschen in den Vereinigten Staaten davon betroffen sind. In der Regel ist es tödlich, und die meisten Patienten sterben innerhalb von fünf Jahren nach der Diagnose. Die erste Phase, eine heimliche Explosion ansonsten normaler weißer Blutkörperchen, kann Monate oder Jahre dauern. Patienten werden häufig durch eine routinemäßige Blutuntersuchung auf den Zustand aufmerksam gemacht. Wenn die Krankheit nicht kontrolliert wird, werden die weißen Blutkörperchen zunehmend abnormal und bilden Helter-Skelter aus bestimmten Stammzellen im Knochenmark, den so genannten myeloiden Zellen. Solche Leukozyten platzen in den Kapillaren, überwältigen die Organe und ersticken das Gewebe, indem sie sauerstofftragende rote Blutkörperchen verdrängen. Der Krankheitsverlauf sei außerordentlich vorhersehbar, sagen die Ärzte, aber aufgrund seines Uhrwerkcharakters hätten Wissenschaftler auch die Möglichkeit gehabt, die molekularen Zahnräder und Federn zu erforschen, die die CML antreiben. Sie verstehen sie besser als jeder andere Krebs.
Anfang Dezember 1999 fuhr George einmal zu LaDonna ins Krankenhaus in Olympia und hielt an einem Safeway, um eine Zeitung zu kaufen. Mr. No Serious ist ein begeisterter Leser, hatte sogar kurz einen Buchladen mit LaDonna betrieben und er verschlang die Zeitung in ihrem Krankenzimmer. Eine experimentelle Leukämiebehandlung sorgte damals für Schlagzeilen. "Leukämie-Pille ist vielversprechend", berichtete Associated Press, "CML-Patienten hatten innerhalb eines Monats nach Beginn der Behandlung ein normales Blutbild." Die Studie wurde an der Oregon Health & Science University (OHSU) in Portland durchgeführt.
George eilte aus dem Krankenzimmer, um LaDonnas Onkologen zu finden.
Ziel für die Intervention
Eine steile, kurvenreiche, von Bäumen gesäumte Straße führt zum Hauptcampus, der sich in der Nähe des Gipfels des 300 Meter hohen Marquam Hill befindet und an nebligen Tagen wie eine märchenhafte Burg über der Stadt zu schweben scheint. Eine weitere Route bis zur OHSU ist die Portland-Straßenbahn: Zwei in der Schweiz gefertigte Gondelwagen aus glänzendem Stahl ragen über der Interstate 5 auf Kabeln empor und pendeln zwischen dem Westufer des Willamette River und einer näher am Rand gelegenen Krankenhausplattform hin und her von einer Klippe, als Herzpatienten von Bord gehen möchten.
Brian Druker kam 1993 an die OHSU, Jahre bevor die Straßenbahn gebaut wurde und das Hall-of-Fame-Wandgemälde im angrenzenden Gang ein Bild von ihm enthielt. Groß, schlaksig und leichtfüßig wie ein Windhund, leise gesprochen, war Druker 38 Jahre alt und hatte gerade neun Jahre am Dana-Farber-Krebsinstitut der Harvard Medical School in Boston verbracht. "Ich habe Krebs als ein Problem angesehen, das man in den Griff bekommen kann", erinnert er sich an den Forschungsweg, den er nach dem Abschluss seines Medizinstudiums an der University of California in San Diego eingeschlagen hat. "Die Leute begannen, einige Hinweise und Hinweise zu bekommen, und es schien mir nur, dass es in meinem Leben wahrscheinlich war, dass es der Wissenschaft und Entdeckung nachgibt."
Bei Dana-Farber landete Druker in einem Labor, in dem er untersuchte, wie eine normale menschliche Zelle zu einem außer Kontrolle geratenen Wachstum führt - zu bösartigen Erkrankungen. Das Labor befasste sich unter anderem mit Enzymen, Proteinen, die andere Moleküle verändern, indem sie sie aufspalten (z. B. Darmenzyme helfen, Nahrung zu verdauen) oder verknüpfen (Haarfollikelenzyme bilden seidige Keratinfasern). Enzyme treten auch in Kettenreaktionen auf, wobei ein Enzym ein anderes aktiviert und so weiter, bis eine komplexe zelluläre Leistung erreicht ist; Auf diese Weise kann eine Zelle einen Prozess wie Wachstum oder Teilung steuern, indem sie eine einzelne Reaktion auslöst, beispielsweise das Kippen des ersten Dominos. Unter der Leitung des Labors, Thomas Roberts, beherrschte Druker zahlreiche Techniken zur Verfolgung und Messung von Enzymen in Gewebeproben und wandte sich schließlich einer an CML.
An der Erarbeitung der Details, warum dieses spezielle Enzym der Schlüssel zu CML ist, waren Hunderte von Wissenschaftlern auf der ganzen Welt beteiligt - Forschungen, die zu mehreren Nobelpreisen führen würden -, aber hier ist im Grunde genommen, wo Druker angefangen hat:
Erstens haben alle CML-Patienten das abtrünnige Enzym in ihren weißen Blutkörperchen.
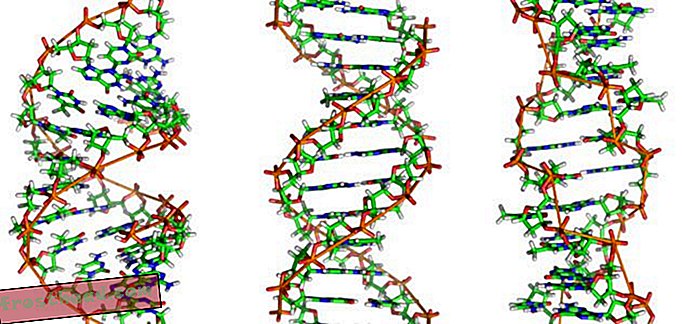
Zweitens ist das Enzym selbst das Produkt eines verrückten Gens namens BCR-ABL, das während der Teilung einer einzelnen myeloischen Stammzelle gebildet und anschließend auf Milliarden von Nachkommen übertragen wird: Die Spitzen zweier Chromosomen, jener spindelförmigen Strukturen, die DNA speichern, tauschen tatsächlich Plätze aus Dadurch verschmelzen die getrennten Gene BCR und ABL (siehe Abbildung). Das neue mutierte BCR-ABL-Gen sitzt auf einem besonderen Chromosom, das 1960 von Wissenschaftlern der University of Pennsylvania entdeckt wurde. Dieses durch ein Mikroskop sichtbare „Philadelphia-Chromosom“ ist das Markenzeichen von CML.
Drittens ist das BCR-ABL-Enzym der böse Zwilling eines normalen Enzyms, das bei der Kontrolle der Produktion weißer Blutkörperchen hilft. Aber wie ein Schalter, der in der "Ein" -Position steckt, spornt die Mutante die wilde Proliferation an, die Leukämie ist.
Sie mussten kein Harvard-Arzt sein, um zu sehen, dass ein einzelnes Enzym, das eine tödliche Leukämie verursacht,, wie Forscher sagen, ein attraktives Ziel für eine Intervention ist. In der Tat machten sich Wissenschaftler daran, Verbindungen zu finden oder zu erfinden, die das BCR-ABL-Enzym blockieren könnten.
Druker und seine Mitarbeiter in Boston entwickelten unter Verwendung von speziell entwickelten Antikörpern eine neue Methode zur Messung der Enzymaktivität - ein Instrument, das für die Bewertung potenzieller CML-Behandlungen von unschätzbarem Wert wäre. Druker, ein in Krawatten gekleideter Arzt unter den promovierten Jean-Professoren, raste gegen Konkurrenten in anderen Forschungszentren, um ein Medikament zu finden, das Krebs unterdrückt, indem es ein kritisches Enzym deaktiviert und gesundes Gewebe schont. Traditionell haben Krebsbehandlungen den Körper mit starken Medikamenten bombardiert, die sowohl gesunde als auch Krebszellen töten - „zytotoxische Chemotherapie“, wie Ärzte es nennen. Die alternative, gezielte Therapie würde Krebs mit weniger Kollateralschäden besser bekämpfen, oder zumindest war dies der Gedanke, der Druker oft bis 23 Uhr im Labor beließ
Dann begannen die Dinge auseinanderzufallen. „Meine Ehe war zusammengebrochen. Ich war nicht das, was Sie einen hingebungsvollen Ehemann nennen würden. Ich war ein engagierter Forscher und Wissenschaftler und Arzt. Und das hat einen Tribut gefordert. “(Druker und seine Frau trennten sich nach zwei Jahren Ehe und ließen sich später scheiden.)
Trotzdem war Druker bereit, die Harvard-Leiter vom Ausbilder zum Assistenzprofessor hinaufzusteigen, da er eine Reihe von veröffentlichten Studien und eine raffinierte Enzymmesstechnik vorzuweisen hatte. "Ich habe mich mit dem Leiter der medizinischen Onkologie bei Dana-Farber zusammengesetzt", erinnerte sich Druker. "Er sah sich meinen Lebenslauf an und sagte:" Ich glaube einfach nicht, dass diese Arbeit hier irgendwo hingehen wird. "Übersetzung:" Mir wurde gesagt, dass ich bei Dana-Farber keine Zukunft habe. "
"Es war schrecklich", erinnerte er sich. "Ich war deprimiert. Aber es zwang mich wirklich zu sagen: Glaube ich an mich selbst? Werde ich es schaffen, einen Unterschied machen? "
Wachsende Bedenken
Auf die Frage, wie Druker vorging, sagte ein Wissenschaftler, es käme auf "Ausdauer und Hartnäckigkeit an, wenn man eine Idee nicht loslässt".
"Ich denke im Grunde, er ist eine schüchterne Person", sagte ein anderer. "Aber in diesem Fall" - Krebstherapie - "ist er wie ein Kreuzfahrer."
"Er nimmt alles, was kompliziert ist, in den Sinn und gibt die einfachstmögliche Interpretation und Intervention aus."
„Wenn du eine Frage stellst, herrscht Stille im Raum, fast unangenehme Stille, und du bist, als hätte er mich überhaupt gehört? Er denkt über die Dinge nach, bevor er eine Antwort gibt. “
"Er lässt die Wissenschaft sprechen."
Druker wuchs als jüngstes von vier Kindern in St. Paul, Minnesota, auf und besuchte öffentliche Schulen mit hervorragenden Leistungen in Mathematik und Naturwissenschaften. Sein Vater war Chemiker bei 3M, dessen Arbeit an Druckverfahren patentiert wurde. Seine Mutter war eine Hausfrau, die sich in die Schulratspolitik einmischte und erfolglos für den Landtag kandidierte. Nach seinem Abschluss in Chemie an der Universität von San Diego blieb er dort und schrieb 1978, als er das erste Jahr an der medizinischen Fakultät war, eine 16-seitige Arbeit, in der er einen Hinweis auf eine Zukunft gab, die er mitgestalten würde. In Langschrift mit blauer Tinte auf liniertem Notizbuchpapier und mit dem Titel „Cancer Chemotherapy“ (Krebschemotherapie) verfasst, kam er zu dem Schluss, dass das Gebiet der Krebschemotherapie eines Tages, wenn die Wirkung von Krebsmedikamenten „biochemisch verstanden wird“, Fortschritte erzielen sollte, die weit über die bereits erzielten Fortschritte hinausgehen. "
Nachdem ihm das Dana-Farber-Krebsinstitut den Penner gegeben hatte, brachte Druker neue Entschlossenheit auf den Plan. "Als ich nach Oregon zog, war es mein Ziel, ein Pharmaunternehmen zu identifizieren, das ein Medikament für CML hatte, und dieses in die Klinik zu bringen", sagte er.
Zuvor hatte er Nick Lydon kennengelernt, einen Biochemiker des Schweizer Pharmakonzerns Ciba-Geigy (der 1996 mit Sandoz zu Novartis fusionierte). Lydon hatte mit Roberts, dem ehemaligen Laborleiter von Druker, zusammengearbeitet. „Ich habe meinen Freund Nick bei Ciba-Geigy angerufen und er sagte:‚ Wir haben das, wonach Sie suchen. '“Es hieß STI571. Firmenchemiker hatten es und andere Verbindungen synthetisiert, als sie nach einem neuen entzündungshemmenden Medikament suchten, aber sie hatten erfahren, dass es auch die Aktivität von Enzymen in einem Reagenzglas blockieren könnte. Trotzdem hatten sie sich nicht ganz entschieden, was sie mit dem Compound anfangen sollten.
Im August 1993 erhielt Druker seine erste Charge flüssiges STI571 und einen weiteren Wirkstoffkandidaten aus der Schweiz. Mit dem von ihm mitentwickelten Enzymmessgerät bestätigte er, dass STI571 das BCR-ABL-Enzym, das zu einer Klasse von Enzymen gehört, die als Tyrosinkinasen bekannt sind, stark inhibierte. die andere Verbindung tat dies nur schwach. Er goss auch winzige Mengen von STI571 in eine Schale mit Behältern in Fingerhutgröße, die Flüssigkeit und lebende weiße Blutkörperchen enthielten, die von einem CML-Patienten stammten. Druker hatte gehofft, dass sich das Wachstum der Zellen verlangsamen oder stoppen würde. Noch besser, die Zellen starben. Darüber hinaus hat eine große Menge an STI571, die gesunden Zellen in einer Schale verabreicht wurde, keinen Schaden angerichtet. "Brians Beitrag war entscheidend", erinnerte sich Lydon, als er das Unternehmen überzeugte, "in diese Richtung zu gehen."
Aber natürlich ist der Weg zu enttäuschten Hoffnungen mit experimentellen Medikamenten gepflastert, die in einem Reagenzglas großartig aussahen, aber bei Menschen versagten. Skeptiker wiesen darauf hin, dass Hunderte verschiedener Arten von Tyrosinkinaseenzymen im Körper wirken, und sie fügten hinzu, dass ein Medikament, das eines blockierte, nicht auch viele andere blockierte und physiologische Verwüstungen anrichtete. "Es gab viele Neinsager, die argumentierten, dass es unmöglich sein würde, spezifische Proteinkinase-Inhibitoren für die Behandlung von Krebs zu entwickeln", schrieb Tony Hunter, Biochemiker am Salk Institute in La Jolla, Kalifornien, im Journal of Clinical Investigation .
Wissenschaftliche Ideen verwurzeln sich nicht wie Löwenzahnsamen, die auf fruchtbaren Boden geweht werden. Sie brauchen Fürsprecher, Leute, die gewinnen wollen. Druker verstummte und führte weitere Experimente durch, z. B. das Induzieren einer Form von CML in Labormäusen und das Unterziehen dieser Mäuse mit STI571. Die Tierkrankheit war so gut wie beseitigt. "Ich habe wahrscheinlich 60 bis 80 Stunden pro Woche gearbeitet", erinnert sich Druker, der in seiner knappen Freizeit an Radrennen teilnahm. Diese Sportart erfordert eine hohe Schmerztoleranz und ein Gespür dafür, wann man aus dem Rudel ausbrechen muss. "Mein Leben in jenen Tagen war, dass ich [im Labor] arbeite, trainiere, esse und schlafe." Was ihn antreibt, sagte er, waren CML-Patienten, die im Sterben liegen.
Bis 1997 hatte Druker zahlreiche Studien mit Mitarbeitern in Portland und der Schweiz veröffentlicht und glaubte, dass das Präparat bereit sei, an Menschen getestet zu werden. Novartis war anderer Meinung. Zum einen führte die intravenöse Gabe des Arzneimittels bei Hunden häufig zu Blutgerinnseln am Ende des Katheters. Die Chemiker von Novartis haben das flüssige Medikament monatelang als Pille umformuliert. Als die Forscher jedoch Hunden große Dosen verabreichten, zeigten die Tiere Anzeichen von Leberschäden. Einige Firmenbeamte, erinnerte sich Druker, rieten dazu, das Projekt ganz fallen zu lassen.
Aber der Hundeleberschaden machte ihm nichts aus. Chemotherapie ist schließlich destruktiv. "Wir wussten, wie man giftige Krebsmedikamente verabreicht", sagte er.
Das nächste, was Druker tat, war vielleicht nicht illegal, aber es war sicherlich nicht koscher. Er überbrückte Novartis und ging direkt zur Food and Drug Administration, um zu sehen, ob er genügend Daten gesammelt hatte, um einen menschlichen Versuch zu starten. "Ich rief den Toxikologen bei der FDA an und sagte:" Hier ist das Problem. Und er sagte: ‚Meine Güte, Sie haben eine Menge Daten, wir würden diesen Antrag wahrscheinlich annehmen. '“ Druker erzählte Novartis dann, was er getan hatte. "Ich habe mich in heißes Wasser gestürzt, weil ich hinter ihren Rücken gegangen war."
Schließlich verabreichte Druker im Juni 1998 mit Genehmigung der FDA einem Menschen, einem 68-jährigen Oregoner mit CML, STI571. "Es war fast antiklimaktisch", erinnerte sich Druker, "insofern waren wir im November 1996 fertig und hier war es über eineinhalb Jahre später."
Er hatte zwei hervorragende Onkologen für die Durchführung der klinischen Studie eingestellt, Moshe Talpaz vom MD Anderson Cancer Center in Houston und Charles Sawyers von der UCLA. Alle in den drei Städten eingeschriebenen CML-Patienten hatten sich einer Interferontherapie unterzogen und waren entweder nicht besser geworden oder hatten einen Rückfall erlitten. Keiner war für eine Knochenmarktransplantation geeignet.
Nach einer allmählichen Erhöhung der STI571-Dosis stellten die Ärzte nach etwa sechs Monaten fest, dass der astronomische Weißblutwert von fast 100.000 Zellen pro Kubikmillimeter auf weniger als 10.000 sank, was durchaus normal war. Eine Analyse der weißen Blutkörperchen eines der ersten Patienten ergab keine Anzeichen des Philadelphia-Chromosoms, was darauf hindeutet, dass die Leukämie an der Quelle gestoppt wurde. Beeindruckender war, dass sich die Spuren des BCR-ABL-Gens nicht mehr selbst kopierten. "Damals wussten wir, dass wir etwas hatten, wie wir es in der Krebstherapie noch nie gesehen hatten", sagte Druker.
Als es im Internet bekannt wurde, wollten andere CML-Patienten. Druker drängte Novartis, mehr von dem Medikament zu produzieren. Aber Novartis war nicht bereit. Die Droge war schwer herzustellen, Daniel Vasella, damals Geschäftsführer von Novartis und jetzt Vorstandsvorsitzender, erinnerte sich in seinem Buch über die Droge Magic Cancer Bullet . "Angesichts der geringen Anzahl von CML-Patienten hatte [das Medikament] auch keine hohe Priorität", fügte er hinzu. Ein sicherer und wirksamer Nachweis wäre zudem mit erheblichen Investitionen verbunden. "Eine schwere Nebenwirkung könnte bei einem von 1.000 Patienten auftreten, und das wäre das Ende der Studie", schrieb er.
Im September 1999 erhielt Druker eine E-Mail von Suzan McNamara, einer 33-jährigen CML-Patientin aus Montreal. Sie hatte Interferon genommen, das ihre Krankheit fast ein Jahr lang unterdrückt hatte, aber jetzt brüllte es zurück, und sie wollte an einer STI571-Studie teilnehmen. „Ich war so krank, dass ich mein Haus kaum noch verlassen konnte“, erinnerte sie sich an mich.
Druker rief sie am nächsten Tag an und sagte, es würde Monate dauern, bis sie sich für eine Studie anmelden könne - Novartis hatte sich nicht verpflichtet, mehr STI571 zu produzieren. Aber, fügte er hinzu, das Unternehmen könnte schneller vorankommen, wenn es direkt von Patienten hörte.
McNamara und ein Freund nutzten eine Internetseite, um eine Petition zu verfassen, in der sie darum ersuchten, das Medikament einer breiteren Öffentlichkeit zugänglich zu machen. Tausende von CML-Patienten befürworteten dies. Sie schickte es mit einem Brief an Vasella: "Wir haben mit wachsender Besorgnis unsere Überzeugung gesehen, dass die Versorgung mit dem Medikament nicht ausreicht, um die Studien so schnell zu erweitern, wie es die bisherigen Beweise rechtfertigen würden."
"Der Brief konnte nicht ignoriert werden", sagte Vasella. Das Unternehmen erhöhte die STI571-Produktion.
Die Ehre, die frühen klinischen Ergebnisse bekannt zu geben, fiel Druker zu. In New Orleans berichtete er am 3. Dezember 1999 einem Auditorium voller Hämatologen, dass alle 31 Patienten in der Studie positiv auf STI571 angesprochen hätten und die Anzahl der weißen Blutkörperchen innerhalb eines Monats auf 30 gesunken sei. Die Nebenwirkungen der Pille - Magenverstimmung, Muskelkrämpfe - wurden von Onkologen als „mild bis mittelschwer“ bezeichnet. Druker sagt, er erinnere sich nicht an stehende Ovationen.
Das Ergebnis war, dass "der Traum eines molekularen Onkologen in Erfüllung gegangen ist", schrieb Harold Varmus, der jetzt das National Cancer Institute leitet und mit einem Nobelpreis für Forschung ausgezeichnet wurde, der einige Grundlagen für den Erfolg von STI571 legte. Die Droge, erinnert er sich in seinem 2009 erschienenen Buch „ The Art and Politics of Science “ ( Die Kunst und Politik der Wissenschaft ) war „der beste Beweis, dass die grundlegendsten Aspekte der Krebsforschung für Krebspatienten dramatische Vorteile hatten.“
CNN, die New York Times, "Good Morning America" und Associated Press berichteten über die bahnbrechende Krebspille.
Welle der Zukunft
Nachdem sich LaDonna Lopossa und ihre Kinder im Februar 2000 verabschiedet hatten, machte sie noch ein paar Tage Pause und vereinbarte einen Termin bei OHSU. LaDonnas Onkologe und George hatten es geschafft, sie in die zweite Phase der STI571-Studie zu bringen, in der etwa 500 neue Patienten in ein Dutzend medizinischer Zentren weltweit aufgenommen wurden. Sie schlurfte auf Georges Arm in die Klinik. "Worauf haben wir uns eingelassen?", Fragte eine der Krankenschwestern, was bedeutete, dass LaDonnas Tod, der unmittelbar bevorstand, als schwarzer Fleck gegen die Droge galt. Ihr weißes Blutbild überstieg 200.000, mehr als das 20-fache des Normalwerts. "Es gab keine zwei Möglichkeiten", sagte Druker. "Du hast sie angeschaut und sie war in Schwierigkeiten."
Sie untersuchten sie und gaben ihr eine STI571-Pille. Sie warf es hoch.
Am nächsten Morgen erwachten George und LaDonna in der Wohnung ihrer Schwester in Portland, und George machte LaDonna zu einem Bananenmilchshake. Später an diesem Tag blieb die STI571-Pille unten. Und das nächste und so weiter.
"Innerhalb von drei Wochen war ihre Milz wieder so gut wie normal", sagte Druker. „Sie fühlte sich großartig. Der weiße Graf war gefallen. Ein Lazarus-ähnlicher Effekt. Es war wirklich ein Wunder. "
Im Mai desselben Jahres besuchten LaDonna und George den Friedhof in Winlock, um Blumen auf die Grabstätte ihrer Mutter zu legen, die sich neben dem Grundstück befindet, das LaDonna für sich gekauft hatte. "Ich soll in diesem Grab sein", sagte sie zu George.
"Nun", sagte er, "da Sie nicht sind, warum machen wir kein Foto?"
Bis zum späten Winter 2001 hatten Druker und seine Mitarbeiter einen Großteil ihrer STI571-Daten gepoolt: Bei etwa 95 Prozent der Patienten war der Normalwert der weißen Blutkörperchen wieder erreicht, und bei 60 Prozent wurde das Philadelphia-Chromosom nicht nachgewiesen. Das Unternehmen reichte die Ergebnisse mit seinem neuen Arzneimittelantrag bei der FDA ein, die es in zweieinhalb Monaten genehmigte - bis heute die schnellste Arzneimittelüberprüfung in der Geschichte der Agentur.
Vor zehn Jahren in diesem Monat gab die US-Regierung bekannt, dass das Medikament, das Novartis Gleevec auf dem nordamerikanischen Markt nannte (Glivec in Europa), für CML-Patienten erhältlich sein wird. Es war ein entscheidender Moment. Das vorige Jahrhundert der Krebsbehandlungen - zeitweise erfolgreich, basierend auf Versuchen und Fehlern, fast immer qualvoll - war Fachleuten als "vor Gleevec" bekannt. Von da an war "nach Gleevec" die Ära der gezielten Therapie. Auf einer Pressekonferenz in Washington, DC, am 10. Mai, bezeichnete der Minister für Gesundheit und menschliche Dienste, Tommy Thompson, die Droge als "Durchbruch" und "Welle der Zukunft". Der damalige Direktor des National Cancer Institute, Richard Klausner, beschrieb es als "ein Bild der Zukunft der Krebsbehandlung".
Heute würde Suzan McNamara zustimmen, dass die Zukunft gut ist. Als sie zum ersten Mal im Jahr 2000 nach Portland reiste, um an der Gleevec-Studie teilzunehmen, erinnerte sie sich: „Ich bin mit halbem Haar und magersüchtig dorthin gegangen und konnte nicht einmal eine Treppe hinaufgehen. Und ich bin in eineinhalb Monaten 20 Pfund schwerer und voller Leben zurückgekommen. “Ihre nächsten Schritte bestanden darin, die McGill-Universität zu besuchen, Leukämietherapien zu studieren und in experimenteller Medizin zu promovieren. Die 44-jährige lebt in Montreal und arbeitet in Ottawa für Health Canada, eine Bundesbehörde. Immer noch auf Gleevec, läuft sie einige Male in der Woche mehrere Meilen. "Ich würde mehr gehen, wenn ich nicht so faul wäre", sagte sie. Im Januar 2010 heiratete sie ihren langjährigen Freund Derek Tahamont in Hawaii. "Er stand mir während der ganzen Krankheit und allem zur Seite", sagte sie. „Wir haben beschlossen, in ein Flugzeug zu steigen und am Strand zu heiraten, nur wir beide. Es war perfekt."
Gleevec hat die Menschen ermutigt zu glauben, Krebs sei nicht immer ein tödlicher Eindringling, der vernichtet werden muss, sondern eine chronische Krankheit, die wie Diabetes behandelt werden kann. In von Druker durchgeführten Folgestudien hatten rund 90 Prozent der neu diagnostizierten CML-Patienten, die mit der Einnahme von Gleevec begonnen hatten, fünf Jahre überlebt. "Ich sage den Patienten, wie optimistisch ich in Bezug auf ihre Zukunft bin", sagte Druker. „Wir gehen für Gleevec von einem durchschnittlichen Überleben von 30 Jahren aus. Jemand, bei dem 60 diagnostiziert wurden, kann 90 Jahre alt werden und an etwas anderem sterben. “
Damals, als LaDonna Lopossa 60 war, sagte Druker, er würde sie bis zu ihrem 70. Lebensjahr am Leben erhalten. Dann erreichte sie diesen Meilenstein. "Ich meinte, als ich 70 wurde", scherzte er dann zu ihr.
LaDonna, jetzt 71, und George, 68, leben in Battle Ground, Washington, einer ländlichen Stadt 24 Meilen nördlich von OHSU, wo LaDonna unter Drukers Obhut bleibt. Die Lopossas wohnen in einem Bungalow in einem staatlich subventionierten Seniorenwohnkomplex gegenüber einer Familie, die Hühner im Hof hält und George Kräuter anbauen lässt. Eine gerahmte Zeitschrift für Gleevec mit LaDonna hängt an einer Wohnzimmerwand. Zwei Porträts von Christus zieren eine Wand des Esszimmers. George, der schnell sagt, er sei nicht religiös - "niemand weiß, wie Jesus aussah", witzelte er LaDonnas Ikonographie -, hat seine eigene Höhle, in der er "Family Guy" ansieht.
LaDonna meldet sich freiwillig bei der North County Community Food Bank in der Mormonenkirche, der sie angehört, und berät telefonisch Menschen, bei denen bei der Leukämie- und Lymphom-Gesellschaft neu CML diagnostiziert wurde. Eine ihrer größten Herausforderungen in diesen Tagen sei es, Patienten davon zu überzeugen, Gleevec weiter einzunehmen. Sie haben die Symptome einer fulminanten CML nicht ertragen und einige empfinden die Nebenwirkungen des Arzneimittels als ärgerlich.
Gleevec hielt LaDonnas CML sieben Jahre lang in Schach. Zu diesem Zeitpunkt wurde ihre Krankheit resistent gegen das Medikament. Glücklicherweise hatten Mediziner und Pharmaunternehmen zwei neue CML-Medikamente entwickelt, die das BCR-ABL-Enzym auf unterschiedliche Weise deaktivieren und eine Art von Gleevec-Resistenz ausgleichen. Sprycel half LaDonna nicht, Tasigna etwa zwei Jahre lang. Jetzt ist sie auf ihrem vierten CML-Medikament, Bosutinib, das noch experimentell ist. "Ihre Leukämie ist die am besten kontrollierte, die es je gab, seit ich mich in den letzten 11 Jahren um sie gekümmert habe", sagte Druker.
Personalisierte Onkologie
Druker, der an dem kleinen runden Konferenztisch in seinem kleinen Eckbüro hoch oben auf Marquam Hill saß, sagte, er habe noch CML studiert, in der Hoffnung zu verstehen, wie man jede letzte mutierte Stammzelle eliminiert, und er habe auch versucht, das "Gleevec-Paradigma" anzuwenden andere Leukämien. Ein leuchtend gelbes Radrenn-Trikot, das vom Tour de France-Champion und Krebsüberlebenden Lance Armstrong getragen und signiert wurde, hing gerahmt an der Wand. Es war ein klarer Tag und der große Vanilleeisportionierer des Mount St. Helens war aus dem Fenster nach Norden zu sehen und das weiße Dreieck des Mount Hood aus dem Bilderbuch konnte durch das Fenster nach Osten gesehen werden. Der Typ, der nicht das Zeug hatte, ein Harvard-Assistenzprofessor zu sein, ist heute der Direktor des Knight Cancer Institute der OHSU, benannt nach Phil Knight, dem Gründer von Nike und gebürtigem Portlander, und seiner Frau Penny, die sich 2008 verpflichtet hat 100 Millionen US-Dollar für die Einrichtung. "Brian Druker ist ein Genie und ein Visionär", sagte Phil Knight zu der Zeit.
Die Ehrungen flossen ein, einschließlich des US-amerikanischen Hauptpreises für die klinische medizinische Forschung Lasker-DeBakey, den Druker 2009 mit Lydon und Sawyers teilte. Von seinen vielen Auftritten in den Nachrichtenmedien würde niemand sein Leben mehr verändern als eine Geschichte über ihn in People, "The Miracle Worker", die im Februar 2001 veröffentlicht wurde. Das Magazin hatte eine Reporterin namens Alexandra Hardy geschickt, um den Drachentöter bei zu interviewen das krankenhaus in den wolken. Die beiden waren 2002 verheiratet und sind Eltern von Holden, Julia und Claire. Druker sagte: „Ich habe jetzt die Möglichkeit, mich vorrangig auf die Familie zu konzentrieren. Das hätte ich vor 10 oder 15 Jahren nicht tun können. “
Für einige Beobachter verlor die Gleevec-Fabel bald ihren Glanz. "Wonder Drug" für Leukämie leidet unter Rückschlag ", berichtete das Wall Street Journal im Jahr 2002, als einige Patienten gegen das Medikament resistent wurden oder es nicht vertragen konnten. Außerdem schienen die Forscher andere Medikamente, die andere Krebsarten lindern sollten, nur schleppend herzustellen, was das Versprechen der Strategie in Frage stellte. Ein Zeitreporter bloggte im Jahr 2006, dass Gleevec eine „Aschenputtel-Droge“ sei - ein Glasschuh, der zu einem einzigartigen Kandidaten passe. Sawyers sagte, er sei es leid, dass Forscher sagten, Gleevec sei ein Unikat, ein Glücksfall.
Die Kosten des Arzneimittels sind seit dem ersten Tag umstritten. In den Vereinigten Staaten beträgt der Jahresvorrat derzeit etwa 50.000 US-Dollar oder 140 US-Dollar pro Pille und Tag. Das ist das Doppelte der ursprünglichen Kosten, die Vasella als „hoch“, aber auch als „fair“ verteidigt hatte, da das Medikament den Patienten eine gute Lebensqualität bietet und die Einnahmen des Unternehmens für die Erforschung anderer Medikamente verwendet werden. (Nach den Gründen für die Preiserhöhung gefragt, lehnte eine Novartis-Sprecherin eine Stellungnahme ab.) In jedem Fall ist ein Medikament, das Novartis aufgrund des zu kleinen Marktes nicht entwickeln wollte, heute ein Blockbuster. Im Jahr 2010 erzielte Gleevec einen weltweiten Umsatz von 4, 3 Milliarden US-Dollar - das Medikament mit dem zweithöchsten Umsatz. Allerdings hat Novartis einkommensschwachen Patienten kostenlose oder ermäßigte Medikamente zur Verfügung gestellt. Im Jahr 2010 unterstützte das Unternehmen rund 5.000 US-amerikanische Patienten mit einer Spende von Gleevec und Tasigna im Wert von 130 Millionen US-Dollar, ebenfalls ein Novartis-Medikament.
Aber Patienten, Ärzte und andere haben sich lange über den Preis von Gleevec beschwert. Marcia Angell, ehemalige Herausgeberin des New England Journal of Medicine, vermutete in ihrem 2004 erschienenen Buch The Truth About the Drug Companies, dass Novartis Patienten auf Gleevec „zerfetzt“. Kürzlich berichteten Ärzte, dass Patienten die Einnahme von Gleevec abgebrochen haben, weil sie es sich trotz des Hilfsprogramms des Unternehmens nicht leisten konnten.
Druker, der sagte, sein Labor habe Novartis-Forschungsgelder erhalten, aber weder er noch OHSU haben jemals Gleevec-Lizenzgebühren verdient, bedauert die Kosten. "Es sollte ein erschwinglicher Preis sein, der im Bereich von 6.000 bis 8.000 USD pro Jahr liegen würde", sagte er mir. "Das Unternehmen würde immer noch reichlich Gewinn machen. Viele Krebsmedikamente sind heutzutage nicht mehr erschwinglich." Das müssen wir als Gesundheitsbranche angehen und angehen. “
Es wird eine Menge zu tun geben: Es scheint, dass Gleevec nicht nur ein Glücksfall war. Allein die Tatsache, dass Wissenschaftler schnell neue Medikamente entwickelt haben, um mit der Gleevec-Resistenz fertig zu werden, zeigt, dass sie zunehmend wissen, was sie tun, sagte Sawyers, der jetzt im Memorial Sloan-Kettering Cancer Center ist. Er leitete eine Gruppe, die als erste den Widerstand erklärte und an der Entwicklung von Sprycel beteiligt war. "Warum bin ich so optimistisch?", Sagte er. "Wir kennen den Feind und wissen, wie man ihn besiegt."
In der Tat haben mehrere auf Enzyme ausgerichtete Krebstherapien die FDA-Zulassung nach Gleevec erhalten, darunter Medikamente gegen bestimmte Formen von Lungenkrebs und Bauchspeicheldrüsenkrebs. Und Forscher sagen, dass sie durch Behandlungen in klinischen Studien ermutigt werden. Einige Melanompatienten, deren Krankheit durch eine bekannte genetische Mutation verursacht wird, scheinen von einem experimentellen Medikament namens PLX4032 stark zu profitieren. Sawyers untersucht eine Form von Prostatakrebs, die von einem mutierten Hormonrezeptor ausgelöst wird, und er bezeichnete die klinischen Tests eines Arzneimittels (MDV3100) als „aufregend“. Eine Analyse der Pharmaindustrie schätzt, dass sich Arzneimittelhersteller derzeit nahezu entwickeln und testen 300 zielgerichtete molekulare Krebstherapien à la Gleevec.
Arul Chinnaiyan, ein auf Krebs spezialisierter Pathologe an der medizinischen Fakultät der Universität von Michigan in Ann Arbor, ist offen über Gleevecs Einfluss. "Wir versuchen, den Erfolg des Programms zu vermarkten", sagte er über seine Versuche, den zielgerichteten Therapieansatz bei soliden Tumoren anzuwenden, die komplexer sind als CML. Jede Art von soliden Tumoren kann von mehreren fehlerhaften Enzymen und Rezeptoren - Proteinstrukturen, die chemische Botschaften übermitteln - gesteuert werden, und die Vielfalt der Mutationen kann von Person zu Person variieren. Chinnaiyan selbst hat zwei verschiedene mutierte Genfusionen analog zu BCR-ABL entdeckt, die scheinbar viele Prostatakrebsarten antreiben. "Der Gedanke ist, wenn wir wissen, dass dies die molekularen Läsionen sind, werden wir in der Lage sein, das Medikament oder die Kombination von Medikamenten entsprechend anzupassen", sagte Chinnaiyan.
Ich habe eines Tages in einer Brauerei in Ann Arbor ein Gefühl dafür bekommen, was er "personalisierte Onkologie" nennt. Auf der anderen Seite des vernarbten Holztischs saß Jerry Mayfield, 62, ein ehemaliger Soldat des Staates Louisiana, und aß einen Cheeseburger mit Speck und nippte an Bier. Bei Mayfield wurde 1999 CML diagnostiziert. Sein Hämatologe teilte ihm damals mit, dass er noch zwei bis drei Jahre zu leben habe. Mayfield fragte, ob experimentelle Medikamente in Betracht zu ziehen seien. Der Arzt sagte nein. Mayfield überprüfte das Internet, erfuhr von STI571 und erstellte eine Website, newcmldrug.com, um andere Patienten zu informieren. Wenn er seinem Heimatarzt zugehört hätte, sagte Mayfield: "Ohne Frage wäre ich heute nicht hier."
Er betreibt immer noch seine Website und lebt heutzutage in Bloomington, Illinois. Er war in Ann Arbor, um Talpaz zu sehen, der an den ersten klinischen Studien von Gleevec in Houston mitgearbeitet hatte, aber an die Universität von Michigan gezogen war. Er kümmert sich seit mehr als einem Jahrzehnt um Mayfield und verabreicht nacheinander zielgerichtete Therapien, als Mayfield resistent wurde oder diese nicht mehr vertrug: Gleevec, Sprycel, Tasigna, Bosutinib und jetzt Ponatinib, ein weiteres experimentelles, Kinase-blockierendes CML-Medikament, das klinische Rennen durchmacht Versuche.
Mayfield ist "ein Aushängeschild für die CML-Therapie", sagte mir Talpaz. "Es geht ihm sehr gut."
Über die dröhnende Musik des Pubs sagte Mayfield über sein BCR-ABL-Gen: "Ich hatte die G250E-Mutation - habe die G250E-Mutation - deshalb wurde ich resistent gegen Gleevec."
Seine Bemerkung klang wie etwas aus einer Zeitmaschine, die in Jahren oder Jahrzehnten programmiert wurde, als die Leute nonchalant über ihre tödlichen genetischen Mutationen und die Medikamente, die sie hemmen, sprechen. Es ist ein Bild, das Druker oft heraufbeschwört. "In nicht allzu ferner Zukunft", schrieb er, als er den Lasker-DeBakey-Preis entgegennahm, "können Kliniker die Tumore von Personen gründlich auf molekulare Defekte untersuchen und jede Person mit spezifischen, wirksamen Therapien ausstatten, die eine dauerhafte Reaktion ergeben." mit minimaler Toxizität. "
Mayfield wurde nie von Druker behandelt, sondern hat ihn konsultiert. "Ich saß vor zehn Jahren vor einem Tag in der Praxis meines Onkologen und mein Handy klingelte", sagte Mayfield. „Es war Dr. Druker. Ich hatte ihm eine E-Mail geschickt. Ich war geschockt. Ich sagte zu meinem Onkologen: "Es ist unhöflich, diesen Anruf anzunehmen, aber das ist mein Held." Er ist so ein freundlicher und sanfter und engagierter Mann, nicht im Geringsten arrogant. Er hat so viele Leben gerettet. Jeder im Land sollte seinen Namen kennen. Er ist die Art von Idol, die wir haben sollten, anstelle von Sportstars. “
Auf der Mayfield-Website befindet sich ein „Anerkennungsalbum“ für Druker, das mit Hommagen von CML-Patienten gefüllt ist. Ein Schnappschuss nach dem anderen zeigt Menschen, die in hellem Sonnenlicht lächeln - wandern, Bäume pflanzen, Champagner trinken - Menschen, die sich bewegt fühlten, als schulden sie ihm alles . Sie reichten Dutzende Gedichte und Limericks ein, wie dieses von einer Patientin namens Jane Graham:
Es war einmal ein Arzt namens Brian
Auf deren Forschung wir uns alle stützten
Er wusste, dass wir krank waren,
Also machte er uns eine Pille,
Und jetzt planen wir nicht mehr.
Anders als erwartet
Druker traf sich mit LaDonna Lopossa im Untersuchungsraum, wo er jeden Donnerstag Studienpatienten sieht. George, der sagt, LaDonna habe eine "unsinkbare Molly Brown-Qualität", hatte sie zu ihrer Untersuchung vom Schlachtfeld vertrieben. Sie saß auf einem Stuhl, während Druker in einem locker sitzenden dunkelblauen Anzug an der Kante eines Untersuchungstisches lehnte. „Ohne dich wäre ich nicht hier“, sagte LaDonna (möglicherweise zu meinem Vorteil).
"Nun, du bist hier", sagte Druker. "Dir gehts gut."
"Ich tanze gut auf der Straße."
"Toll. Irgendwelche Probleme?"
"Nein. Ich habe nur einen Ausschlag. "
"Wann hat das angefangen?"
"Vor ungefähr zehn Wochen."
Er fragte nach dem Ausschlag, und später verließ ich den Raum, damit er sie untersuchen konnte.
„Arbeitest du immer noch in der Essensausgabe?“, Fragte er.
"Ich mache einen Tag pro Woche."
"Wie läuft das?"
"Großartig."
"Wie ist deine Energie?"
„Meine Energie ist niedrig. Aber mein Gehirn ist aktiv. "
"Du machst es einfach spektakulär, was Leukämie betrifft."
"Ich weiß es. Ich kann es fühlen."
"Was sonst? Fragen an mich? "
"Ich gehe morgen auf eine Reise."
"Zu?"
„San Diego und Knott's Berry Farm mit all meinen Enkeln.“ Sie aktualisierte ihre Fortschritte und Druker rezitierte ihr Alter, als wollte er überprüfen, ob die Fakten stimmen. Wenn er Wissenschaftler auf Fachkonferenzen anspricht, zeigt er häufig Fotografien von LaDonna und ihren Enkelkindern. Entgegen aller Erwartungen, sagt er, werde sie ihre Urenkel aufwachsen sehen.
"Ich habe so ein wundervolles Leben", sagte LaDonna und riss sich auf. „Und ich wollte es nicht. Ich sagte meinen Ärzten: "Tu mir nichts mehr an." "
Sie tupfte sich die Augen mit einem Papiertaschentuch ab und erwähnte ihren ersten Besuch in der Klinik im Jahr 2000, als sie es kaum durch die Tür geschafft hatte. "Das ist lange her", sagte sie zu niemandem.
Dann sagte sie zu Druker: "Aber es ist schnell gegangen, nicht wahr?"
"Hat es nicht?", Sagte er.
Terence Monmaney schrieb 1985 zum ersten Mal für Smithsonian . Er ist Executive Editor. Robbie McClaran aus Portland fotografierte seine Wahlheimat für die Novemberausgabe 2010.








 LaDonna Lapossa posiert 2000 auf ihrem Friedhofsgrundstück. (Mit freundlicher Genehmigung von Ladonna Lapossa)
LaDonna Lapossa posiert 2000 auf ihrem Friedhofsgrundstück. (Mit freundlicher Genehmigung von Ladonna Lapossa)  "Wir sehen nur den Beginn, Patienten mit dem richtigen Medikament zusammenzubringen und sehen rasche Verbesserungen", sagt Dr. Brian Druker. (Robbie McClaran)
"Wir sehen nur den Beginn, Patienten mit dem richtigen Medikament zusammenzubringen und sehen rasche Verbesserungen", sagt Dr. Brian Druker. (Robbie McClaran)  Bei Jerry Mayfield in seinem Haus in Bloomington, Illinois, wurde 1999 Leukämie diagnostiziert. Er hatte zwei bis drei Jahre zu leben. "Ich hatte gehofft, das Jahrtausend zu sehen", sagt der ehemalige Staatspolizist, der eine Website über eine neue Therapie erstellt hat, die er begonnen hat. (Tim Klein)
Bei Jerry Mayfield in seinem Haus in Bloomington, Illinois, wurde 1999 Leukämie diagnostiziert. Er hatte zwei bis drei Jahre zu leben. "Ich hatte gehofft, das Jahrtausend zu sehen", sagt der ehemalige Staatspolizist, der eine Website über eine neue Therapie erstellt hat, die er begonnen hat. (Tim Klein)  Suzan McNamara war schwer an Leukämie erkrankt und begann im Jahr 2000 mit der Einnahme der Droge Gleevec. Zehn Jahre später heiratete sie auf Hawaii. (Mit freundlicher Genehmigung von Suzan McNamara)
Suzan McNamara war schwer an Leukämie erkrankt und begann im Jahr 2000 mit der Einnahme der Droge Gleevec. Zehn Jahre später heiratete sie auf Hawaii. (Mit freundlicher Genehmigung von Suzan McNamara)  "Dies ist eine sehr aufregende Zeit für die Krebsforschung", sagt Arul Chinnaiyan (hier in seinem Labor an der Universität von Michigan), der von Gleevecs Erfolg inspiriert ist. "Ich bin sehr optimistisch, dass die Technologie so weit fortgeschritten ist, dass wir den genetischen Ursprung verschiedener Krebsarten herausfinden können." (Fabrizio Costantini / Aurora Select)
"Dies ist eine sehr aufregende Zeit für die Krebsforschung", sagt Arul Chinnaiyan (hier in seinem Labor an der Universität von Michigan), der von Gleevecs Erfolg inspiriert ist. "Ich bin sehr optimistisch, dass die Technologie so weit fortgeschritten ist, dass wir den genetischen Ursprung verschiedener Krebsarten herausfinden können." (Fabrizio Costantini / Aurora Select)  "Wenn du fast gestorben bist, bekommst du eine andere Perspektive auf das Leben", sagt Lopossa bei ihrem Ehemann George. "Sie haben mehr Wertschätzung für das, was wir haben." (Robbie McClaran)
"Wenn du fast gestorben bist, bekommst du eine andere Perspektive auf das Leben", sagt Lopossa bei ihrem Ehemann George. "Sie haben mehr Wertschätzung für das, was wir haben." (Robbie McClaran)  Was verursacht einen tödlichen Blutkrebs? Zellproduktion Im Knochenmark produzieren einige Stammzellen sauerstofftragende rote Blutkörperchen, während andere weiße Blutkörperchen oder Leukozyten bilden, die meistens Verletzungen heilen und Infektionen bekämpfen. Der Eiter einer infizierten Wunde ist größtenteils von Leukozyten weiß gefärbt. (Illustration für Smithsonian )
Was verursacht einen tödlichen Blutkrebs? Zellproduktion Im Knochenmark produzieren einige Stammzellen sauerstofftragende rote Blutkörperchen, während andere weiße Blutkörperchen oder Leukozyten bilden, die meistens Verletzungen heilen und Infektionen bekämpfen. Der Eiter einer infizierten Wunde ist größtenteils von Leukozyten weiß gefärbt. (Illustration für Smithsonian ) 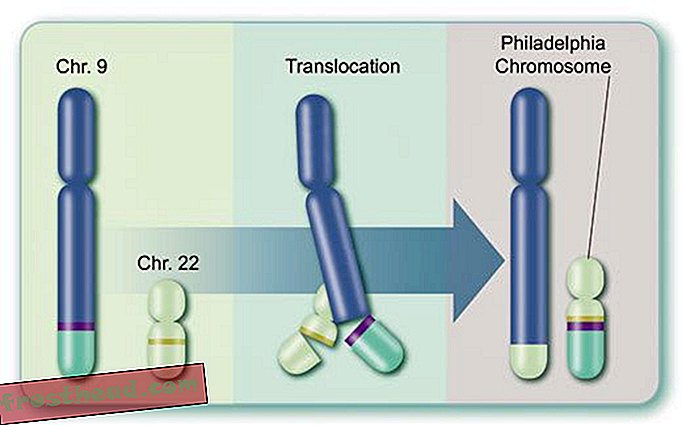 Chromosomen kreuzen versehentlich Pfade br> CML entsteht, wenn sich eine Stammzelle während der Teilung irrt. Anstatt die 23 Chromosomenpaare genau zu duplizieren, wechseln die Bits der Chromosomen Nr. 9 und Nr. 22 die Position und erzeugen ein abweichendes "Philadelphia-Chromosom", das ein mutiertes Gen trägt. (Illustration für Smithsonian )
Chromosomen kreuzen versehentlich Pfade br> CML entsteht, wenn sich eine Stammzelle während der Teilung irrt. Anstatt die 23 Chromosomenpaare genau zu duplizieren, wechseln die Bits der Chromosomen Nr. 9 und Nr. 22 die Position und erzeugen ein abweichendes "Philadelphia-Chromosom", das ein mutiertes Gen trägt. (Illustration für Smithsonian ) 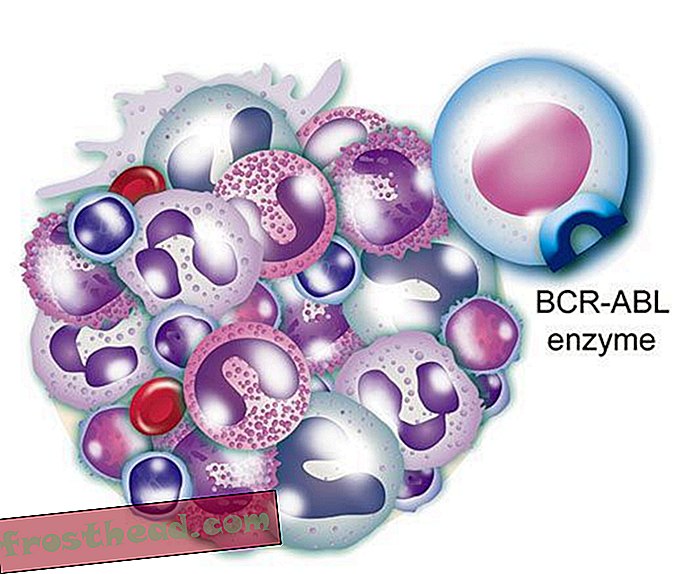 Ein Medikament, das das Ziel erreicht Das mutierte Gen produziert ein abtrünniges Enzym mit dem gleichen Namen, BCR-ABL. Es spornt außer Kontrolle geratene weiße Blutkörperchen oder Leukämie an. (Illustration für Smithsonian )
Ein Medikament, das das Ziel erreicht Das mutierte Gen produziert ein abtrünniges Enzym mit dem gleichen Namen, BCR-ABL. Es spornt außer Kontrolle geratene weiße Blutkörperchen oder Leukämie an. (Illustration für Smithsonian ) 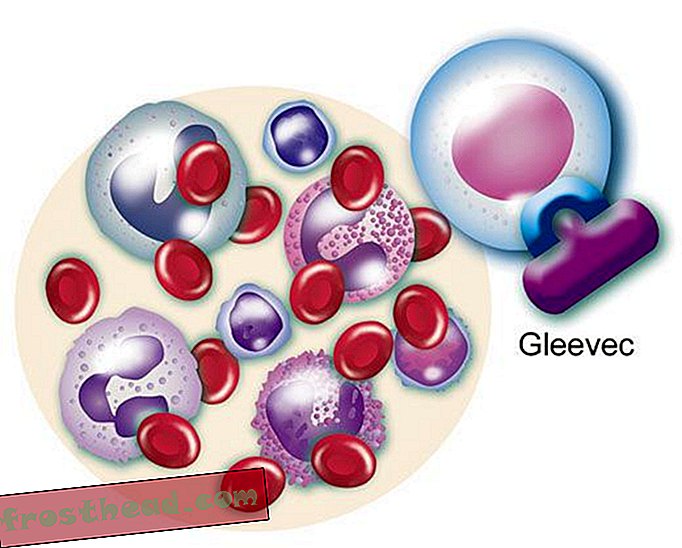 Ein Medikament, das das Ziel erreicht Das CML-Medikament Gleevec blockiert die Enzym-Lock-and-Key-Methode in der Zelle und stellt das normale Wachstum der weißen Blutkörperchen wieder her. (Illustration für Smithsonian )
Ein Medikament, das das Ziel erreicht Das CML-Medikament Gleevec blockiert die Enzym-Lock-and-Key-Methode in der Zelle und stellt das normale Wachstum der weißen Blutkörperchen wieder her. (Illustration für Smithsonian )